Atomul
Atomul este
cea mai mică particulă dintr-o substanță, neputând fi divizat prin procedee
chimice obișnuite.
Structura atomului:
1. Nucleul este
partea centrală a atomului: particule
numite nucleoni:
- Protoni, particule încărcate cu sarcină pozitivă= p+1.
- Neutroni, particule neutre din punct de vedere electric= n0.
2. Învelișul electronic format
din electroni care
gravitează în jurul nucleului, au sarcină negativă=e-1 sau ē.
Numărul atomic, Z = nr. p+ =
nr. ē
Numărul de masă, A = nr. p+ +
nr. n0
Numărul de neutroni din nucleu: N
= A – Z
Învelișul electronic are
o structură stratificată: format din șapte straturi concentrice nucleului și
numerotate de la nucleu către exterior cu 1, 2, 3, 4 ..7 sau cu litere: K, L,
M, N, O, P și Q. Într-un atom, electronii tind să ocupe pozițiile cele mai
stabile, caracterizate de energia cea mai mică. Energia straturilor crește de
la primul strat din jurul nucleului spre exterior.
Caracteristicile
electronilor:
- Sunt
identici, au masa=9,1 X 10-31 kg
- Aceleași
dimensiuni
- Aceeași
sarcină electrică:q= 1,6 x 1019 C
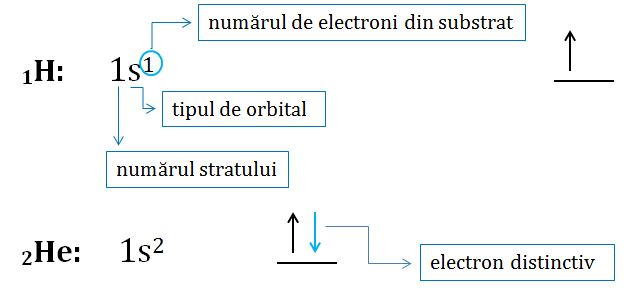
Configurația
electronică-distriuția electronilor în: straturi, substraturi, orbitali.
Clasificarea orbitalilor:
1.
Orbitalii de tip s au formă
sferică, fiecare strat conține un singur orbital de tip s. Substratul s are maxim 2
electroni.
2.
Orbitalii de tip p au formă bilobară, fiecare strat conține trei
orbitali p. Substratul p are maxim 6 electroni.
3.
Orbitalii de tip d apar de la stratul 3 și sunt în număr de 5. Substratul d are maxim 10
electroni.
4.
Orbitalii de tip f apar de la stratul 4 și sunt în număr de 7. Substratul f are maxim 14
electroni.
Numărul maxim de electroni de pe un nivel energetic
este:= 2n2, unde n = nr.strat.
Regulile pentru configurația electronică sunt:
-ocuparea cu electroni se face începând cu stratul K
-un orbital poate fi ocupat de doi electroni de spin
opus
-regula lui Hund: un orbital se va ocupa cu al 2-lea
electron doar după ce toți orbitalii substratului respectiv se ocupă cu câte un
electron.

Niciun comentariu:
Trimiteți un comentariu